《医疗器械监督管理条例》(国务院令第650号)第十五条:“医疗器械注册证有效期为5年。有效期届满需要延续注册的,应当在有效期届满6个月前向原注册部门提出延续注册的申请。除有本条第三款规定情形外,接到延续注册申请的食品药监管理部门应当在医疗器械注册证有效期届满前作出准予延续的决定。逾期未作决定的,视为准予延续。有以下情形之一的,不予延续注册:1.注册人未在规定期限内提出延续注册申请的;2.医疗器械强制性标准已经修订,申请延续注册的医疗器械不能达到新要求的;3.对用来医治罕见疾病以及应对突发公共卫生事件急需的医疗器械,未在规定期限内完成医疗器械注册证载明事项的。”
(2)医疗器械品质差事件汇总分析评价报告,报告应对本产品上市后发生的可疑不良事件列表、说明在每一种情况下生产企业采取的处理和解决方案。对上述不良事件做多元化的分析评价,阐明不良事件发生的原因并对其安全性、有效性的影响予以说明。
(6)原医疗器械注册证中载明要求继续完成工作的,应当提供相关总结报告,并附相应资料。
如医疗器械强制性标准已经修订,应提供产品能达到新要求的产品检验报告。产品检验报告可以是自检报告、委托检验报告或符合强制性标准实施通知规定的检验报告。其中,委托检验报告应由具有医疗器械检验资质的医疗器械检验机构出具。
(1)注册人声明本产品符合《医疗器械注册管理办法》和相关法规的要求;声明本产品符合现行国家标准、行业标准,并提供符合规定标准的清单。
如在原医疗器械注册证有效期内发生了涉及产品技术方面的要求变更的,应当提交依据注册变更文件修改的产品技术方面的要求一式两份。
(2)医疗器械品质差事件汇总分析评价报告,报告应对医疗器械上市后发生的可疑不良事件列表、说明在每一种情况下生产企业采取的处理和解决方案。对上述不良事件做多元化的分析评价,阐明不良事件发生的原因并对其安全性、有效性的影响予以说明。
(6)原医疗器械注册证中载明要求继续完成工作的,应当提供相关总结报告,并附相应资料。
如医疗器械强制性标准已经修订,应提供产品能达到新要求的产品检验报告。产品检验报告可以是自检报告、委托检验报告或符合强制性标准实施通知规定的检验报告。其中,委托检验报告应由具有医疗器械检验资质的医疗器械检验机构出具。
如有国家标准品、参考品发布或者更新的,应提供产品能够符合国家标准品、参考品要求的产品检验报告。产品检验报告可以是自检报告、委托检验报告或符合相应通知规定的检验报告。
(1)注册人声明本产品符合《体外诊断试剂注册管理办法》和相关法规的要求;声明本产品符合现行国家标准、行业标准,并提供符合规定标准的清单。
如在原注册证有效期内发生了涉及产品说明书和/或产品技术方面的要求变更的,应当提交依据注册变更文件修改的产品说明书和/或产品技术方面的要求各一式两份。
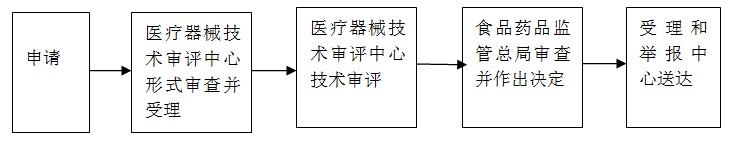
申请人按照本《指南》第八条要求,向国家食品药品监督管理总局行政受理服务大厅提出申请,受理人员按照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2014年第43号)和《关于印发境内第三类和进口医疗器械注册审批操作规范》、《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》 (2014年第44号)的要求对申报资料做形式审查。
申请事项属于本部门职权范围,申报资料齐全、符合形式审查要求的,予以受理;申报资料存在可以当场更正的错误的,允许申请人当场更正;申报资料不齐全或者不符合形式审查要求的,在5个工作日内一次告知申请人需要补正的全部内容,逾期不告知的,自收到申报资料之日起即为受理;申请事项不属于本部门职权范围的,即时告知申请人不予受理。
需要外聘专家审评、药械组合产品需与药品审评机构联合审评的,所需时间不计算在内,技术审评机构应当将所需时间书面告知申请人。质量管理体系核查的时间和申请人补充资料的时间,不计算在审评时限内。
国家食品药监管理总局应当在技术审评结束后20个工作日内作出决定,对符合安全、有效要求的,准予注册。对不予注册的,应当书面说明理由,并同时告知申请人享有申请复审和依法申请行政复议或者提起行政诉讼的权利。
自作出审批决定之日起10个工作日内,总局行政事项受理服务和投诉举报中心将行政许可决定送达申请人。
2.行政许可决定:20个工作日(不含技术审评和申请人补充资料及补充资料审评所需的时间)。20个工作日内不能做出决定的,经总局领导批准,可延长10个工作日。
(三)收费依据:国家发展改革委《关于重新发布中央管理的食品药监管理部门行政事业性收费项目的通知》(财税〔2015〕2号)和《关于印发〈药品、医疗器械产品注册收费标准管理办法〉的通知》(发改价格〔2015〕1006号),《国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告》(2015年第53号)。
中华人民共和国医疗器械注册证、中华人民共和国医疗器械注册证(体外诊断试剂)
自作出审批决定之日起10个工作日内,总局行政事项受理服务和投诉举报中心将行政许可决定送达申请人。
(二)根据《医疗器械注册管理办法》第三十六条,受理注册申请的食品药品监督管理部门对不予注册的,应当书面说明理由,并同时告知申请人享有申请复审和依法申请行政复议或者提起行政诉讼的权利。
(三)依据《中华人民共和国行政许可法》、《医疗器械注册管理办法》等,申请人依法履行以下义务:
公交:乘坐56路,78路,395路,423路在槐柏树街西口下车,步行222米即到。乘坐42路,46路,49路,691路在天宁寺桥东下车,步行252米即到。乘坐26路,390路,395路,423路,456路,662路,691路在西便门下车,步行263米即到。
