原标题:医美 锦波生物:薇旖美「3+17型」胶原发布,引领「全程抗衰」健康新美学
2023年12月12日,锦波生物(832982.BJ)旗下薇旖美®「3+17型胶原」上市发布会在北京举行。薇旖美®「3+17型胶原」作为全球首创胶原联合,借助III型胶原蛋白与XVII型胶原蛋白两款产品的协同作用,实现维稳、修复、重塑、倍护,开辟胶原修复抗衰赛道新蓝海。

据悉,薇旖美®「全程抗衰3+17治疗方案」作为全球首创的胶原联合全程抗衰的治疗方案,包含多型别、多需求、全层次、全场景等特性的全新治疗理念,以维稳、修复、重塑、倍护为核心,借助100%人源化的III+XVII胶原蛋白联合应用,先进行多层次联合维稳修复,增强皮肤的多层屏障作用,再直补缺失胶原,进行多层次联合抗衰重塑,最后搭配定制化的术后护理,减少敏感反复,实现“既修复又抗衰”的双重功效。薇旖美®「全程抗衰3+17治疗方案」中的两款产品分别为三类器械的重组III型人源化胶原蛋白冻干纤维和二类器械的重组XVII型人源化胶原蛋白修护冻干粉, 前者的主要成份为III型胶原,后者的主要成分为XVII型胶原。截止目前,锦波生物共有两款三类重组III型胶原蛋白医美针剂均已获得国家药监局批准上市,一款是重组III型人源化胶原蛋白冻干纤维,注册证号:国械注准;另一款是注射用重组III型人源化胶原蛋白溶液,注册证号:国械注准,两款产品的适合使用的范围均为用于面部真皮组织填充以纠正额部动力性皱纹(包括眉间纹、额头纹和鱼尾纹)。


山西锦波生物医药股份有限公司成立于2008年3月,专注“功能蛋白”基础研究与产业化,牵头联合复旦大学,历经十余年时间的研究开发,且国际首次成功实现了人源III型胶原蛋白的大规模产业化。目前国内拥有重组人源胶原蛋白医疗器械注册证的生产企业中,实现产品多样化、规模化的仅有锦波生物与陕西巨子生物。

锦波生物一直专注于功能蛋白基础研究、开发和产业化,企业具有国家发明专利 13 项,并连续三届被认定为“国家高新技术企业”,在领域内拥有着领先世界的核心技术,为客户提供自主研发和生产的功能蛋白为核心原料的各种功能蛋白产品。2021年3月23日,锦波生物完成了重组Ⅲ型人源化胶原蛋白医疗器械原材料主文档登记,成为国家药监局颁布实施主文档登记制度以来,我国第一个获得医疗器械原材料登记的企业。

锦波生物旗下的主要营业产品主要是重组胶原蛋白产品和抗HPV生物蛋白产品,其中,在重组胶原蛋白产品领域,基本的产品包括重组Ⅲ型人源化胶原蛋白冻干纤维、创面及粘膜修复敷料、功能性护肤品等;在抗HPV生物蛋白产品领域,基本的产品为抗HPV生物蛋白敷料等。同时,重组胶原蛋白产品和抗HPV生物蛋白产品是分别基于公司自主研发的重组Ⅲ型胶原蛋白及酸酐化牛β-乳球蛋白为核心成分。

2015年7月,锦波生物在新三板正式成功挂牌上市;2019年12月2日,锦波生物更改上市辅导机构,并重新进入上市辅导期;2020年6月1日,上交所受理锦波生物的科创板首发上市申请,随后其股票在新三板停牌;2020年12月24日,锦波生物向上交所递交《关于撤回首次公开发行股票并在科创板上市申请文件的申请》;2020年12月28日,上交所终止对锦波生物在科创板首次公开发行股票的审核;2020年12月30日,锦波生物在新三板复牌;2021年12月22日, 锦波生物进入北交所上市辅导期;2022年5月24日,锦波生物通过辅导验收;2022年5月27日,锦波生物向北交所报送了IPO申报材料;2022年6月7日,锦波生物的上市申请获北交所受理;2022年11月24日,锦波生物完成第二轮问询回复;2023年3月24日,锦波生物顺利过会,即将登陆北交所。2023年6月29日,锦波生物成功上市,成为北交所“重组胶原蛋白第一股”,同时也是国内第二家重组胶原蛋白上市企业。

2021年3月15日,国家药监局对外发布《重组胶原蛋白生物材料命名指导原则》(2021年第21号通告)。根据《命名指导原则》,重组胶原蛋白分为重组人胶原蛋白、重组人源化胶原蛋白、重组类胶原蛋白三类。但由于生物合成技术水平受限,目前市场上未出现重组人胶原蛋白,只有重组人源化胶原蛋白和重组类胶原蛋白两类产品。

2021年6月29日,锦波生物申请的““重组Ⅲ型人源化胶原蛋白冻干纤维””成功获得国家药监局批准上市,注册证号:国械注准,商品名为薇旖美®极纯Ⅲ型,是国内首款且唯一一款可用于面部除皱注射的重组人源化胶原蛋白,同时也是全球唯一具有活性、结构明确的100%人源化胶原蛋白。

2023年1月29日,国家药品监督管理局发布最新《重组人源化胶原蛋白》医疗器械行业标准,将重组人源化胶原蛋白根据其氨基酸序列是否添加非人胶原蛋白氨基酸序列,分为A型和B型。而锦波生物研发的“重组Ⅲ型人源化胶原蛋白冻干纤维”被定义为A型人源化胶原蛋白(即不含有非人胶原蛋白氨基酸序列)
2022年1月18日,国家药监局对外发布YY/T 1849-2022《重组胶原蛋白》行业标准。该标准规定了重组胶原蛋白的质量控制要求、检测指标及其检测的新方法等,适用于作为医疗器械原材料的重组胶原蛋白的质量控制,将于2022年8月1日正式实施。

2022年4月24日,国家药监局发布通知,批准《重组人源化胶原蛋白》医疗器械行业标准制修订项目立项,并要求相关单位采用快速程序开展标准制定。该项目归口单位为国家药监局医疗器械技术审评中心,标准制定完成后将作为推荐性行业标准发布。

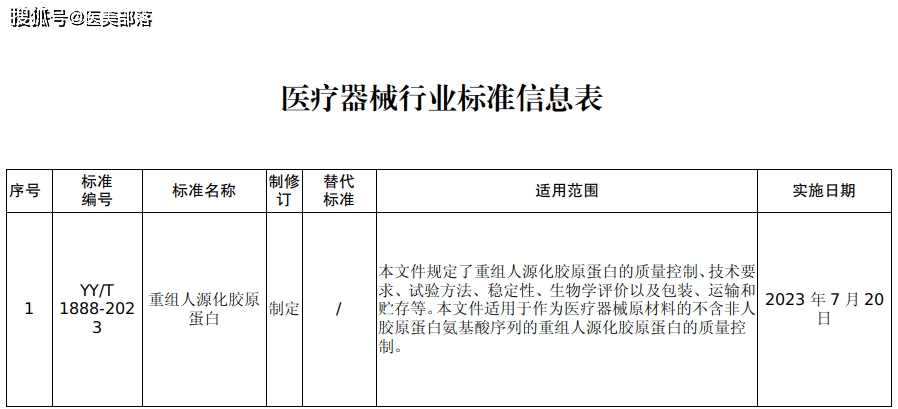
2023年1月28日,国家药品监督管理局官网发布了重要的公告,YY/T 1888-2023《重组人源化胶原蛋白》医疗器械行业标准已经审定通过,将于2023年7月20日正式实施。

2023年1月29日,国家药品监督管理局医疗器械标准管理中心发布了《重组胶原蛋白生物材料命名指导原则》解读,以更好地指导和规范重组胶原蛋白医疗器械的命名工作。

2023年2月15日,锦波生物于PCHi展会全球首发了一款重组胶原蛋白新品3kDa小分子micoreCol.Ⅲ产品(属A型重组Ⅲ型人源化胶原蛋白),并与青眼情报联合发布了《重组胶原蛋白护肤品市场趋势洞察报告》。

2023年6月6日,锦波生物旗下薇旖美®至真上市发布会在龙城太原荣耀发布,薇旖美®至线°三螺旋结构基础上,通过2年技术创新实现NSA超螺旋结构,为广大购买的人带来了创新的年轻化治疗方案,打造了全新的抗衰赛道。

除此之外,锦波生物旗下的锦波合成生物产业园是山西省级重点工程建设项目,总规划面积300亩,分三期开发建设。产业园致力于运用前沿生物算法、结构生物学、合成生物学等技术,研发制造具有高级结构和功能的新型生物材料,可大规模生物合成具有高级结构和功能的人源化胶原蛋白,实现功能蛋白的绿色智造。

2022年9月22日,锦波合成生物产业园一期正式开园试产,占地面积约100亩,致力于高端注射级产品和原材料绿色制造;2023年4月,锦波合成生物产业园一期项目建成,是我国顶级规模、最专业的A型人源化胶原蛋白生物新材料制造基地,正式投产后可实现年产注射级A型人源化胶原蛋白400万支。

2023年8月28日,山西锦波生物申请的“注射用重组III型人源化胶原蛋白溶液”成功获得国家药监局批准上市,注册证号:国械注准,这是锦波生物继2021年6月“重组III型人源化胶原蛋白冻干纤维”薇旖美®获批后的又一款重组胶原医美针剂。

2023年10月26日,锦波生物发布2023年三季报,公司前三季度实现盈利收入5.17亿元,同比增长105.64%;归属上市公司股东净利润1.92亿元,同比增长173.75%。其中,第三季度,公司实现盈利收入2.01亿元,同比增长106.43%;归属上市公司股东净利润8284.27万元,同比增长168.75%。
